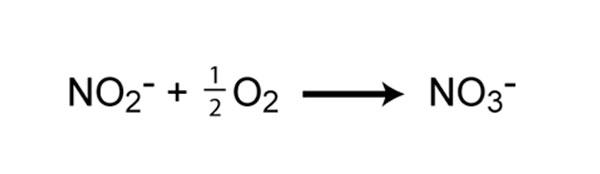El ciclo del nitrógeno: procesos, actores e impacto humano
El nitrógeno es uno de los nutrientes primarios críticos para la supervivencia de todos los organismos vivos. Aunque el nitrógeno es muy abundante en la atmósfera, es en gran parte inaccesible en esta forma para la mayoría de los organismos. Este artículo explora cómo el nitrógeno se vuelve disponible para los organismos y qué significan los cambios en los niveles de nitrógeno como resultado de la actividad humana para los ecosistemas locales y globales.

Introducción
El nitrógeno es uno de los nutrientes primarios críticos para la supervivencia de todos los organismos vivos. Es un componente necesario de muchas biomoléculas, incluidas proteínas, ADN y clorofila. Aunque el nitrógeno es muy abundante en la atmósfera como gas dinitrógeno (N 2 ), es en gran parte inaccesible en esta forma para la mayoría de los organismos, lo que hace que el nitrógeno sea un recurso escaso y a menudo limita la productividad primaria en muchos ecosistemas. Solo cuando el nitrógeno se convierte del gas dinitrógeno en amoníaco (NH 3 ), está disponible para los productores primarios, como las plantas.
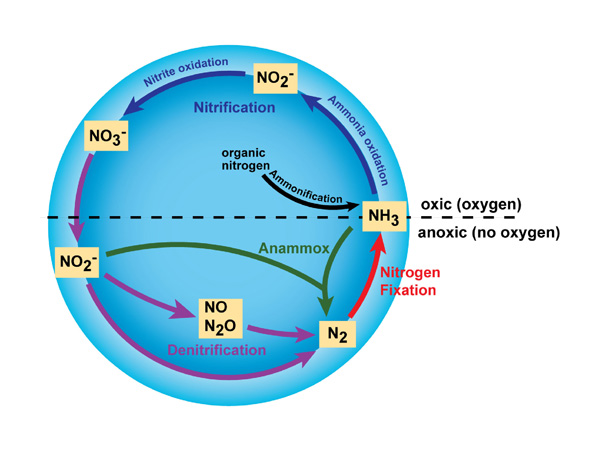
Además de N 2 y NH 3 , el nitrógeno existe en muchas formas diferentes, incluidas formas inorgánicas (p. Ej., Amoniaco, nitrato) y orgánicas (p. Ej., Aminoácidos y ácidos nucleicos). Por lo tanto, el nitrógeno sufre muchas transformaciones diferentes en el ecosistema, cambiando de una forma a otra a medida que los organismos lo utilizan para el crecimiento y, en algunos casos, la energía. Las principales transformaciones del nitrógeno son la fijación de nitrógeno, la nitrificación, la desnitrificación, el anammox y la amonificación (Figura 1). La transformación del nitrógeno en sus muchos estados de oxidación es clave para la productividad en la biosfera y depende en gran medida de las actividades de un conjunto diverso de microorganismos, como bacterias, arqueas y hongos.
Figura 1: Principales transformaciones en el ciclo del nitrógeno.
Desde mediados del siglo XX, los seres humanos han ejercido un impacto cada vez mayor en el ciclo global del nitrógeno. Las actividades humanas, como la fabricación de fertilizantes y la quema de combustibles fósiles, han alterado significativamente la cantidad de nitrógeno fijo en los ecosistemas de la Tierra. De hecho, algunos predicen que para el 2030, la cantidad de nitrógeno fijado por las actividades humanas superará la fijada por los procesos microbianos (Vitousek 1997). Los aumentos en el nitrógeno disponible pueden alterar los ecosistemas al aumentar la productividad primaria y afectar el almacenamiento de carbono (Galloway et al . 1994). Debido a la importancia del nitrógeno en todos los ecosistemas y al impacto significativo de las actividades humanas, el nitrógeno y sus transformaciones han recibido una gran atención por parte de los ecologistas.
Fijación de nitrogeno
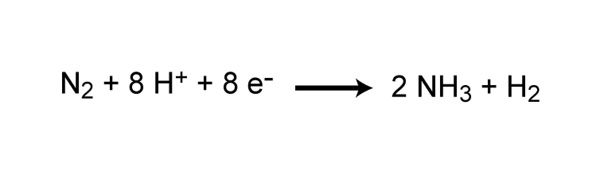
El gas nitrógeno (N 2 ) constituye casi el 80% de la atmósfera de la Tierra, sin embargo, el nitrógeno es a menudo el nutriente que limita la producción primaria en muchos ecosistemas. ¿Por qué esto es tan? Porque las plantas y los animales no pueden utilizar gas nitrógeno en esa forma. Para que el nitrógeno esté disponible para producir proteínas, ADN y otros compuestos biológicamente importantes, primero debe convertirse en una forma química diferente. El proceso de convertir N 2 en nitrógeno biológicamente disponible se llama fijación de nitrógeno. N 2El gas es un compuesto muy estable debido a la fuerza del triple enlace entre los átomos de nitrógeno, y requiere una gran cantidad de energía para romper este enlace. Todo el proceso requiere ocho electrones y al menos dieciséis moléculas de ATP (Figura 2). Como resultado, solo un grupo selecto de procariotas puede llevar a cabo este proceso energéticamente exigente. Aunque la mayor parte de la fijación de nitrógeno la realizan los procariotas, parte del nitrógeno puede fijarse abióticamente mediante rayos o ciertos procesos industriales, incluida la combustión de combustibles fósiles.
Figura 2: Reacción química de la fijación de nitrógeno.
Figura 3: Nódulos fijadores de nitrógeno en la raíz de una planta de trébol
Algunos organismos fijadores de nitrógeno son de vida libre, mientras que otros son fijadores de nitrógeno simbióticos, que requieren una asociación cercana con un huésped para llevar a cabo el proceso. La mayoría de las asociaciones simbióticas son muy específicas y tienen mecanismos complejos que ayudan a mantener la simbiosis. Por ejemplo, los exudados de las raíces de las plantas leguminosas (p. Ej., Guisantes, trébol, soja) sirven como señal para ciertas especies de Rhizobium , que son bacterias fijadoras de nitrógeno. Esta señal atrae a las bacterias a las raíces, y luego ocurre una serie de eventos muy compleja para iniciar la absorción de las bacterias en la raíz y desencadenar el proceso de fijación de nitrógeno en los nódulos que se forman en las raíces (Figura 3).
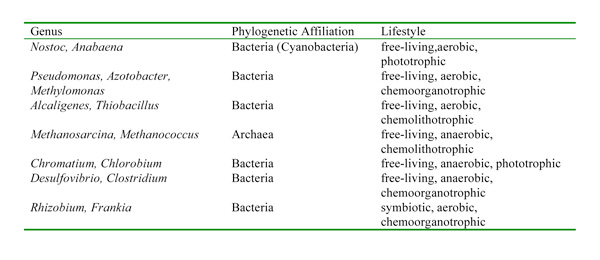
Algunas de estas bacterias son aeróbicas, otras son anaeróbicas; algunos son fototróficos, otros son quimiotróficos (es decir, utilizan sustancias químicas como fuente de energía en lugar de luz) (Tabla 1). Si bien existe una gran diversidad fisiológica y filogenética entre los organismos que realizan la fijación de nitrógeno, todos tienen un complejo enzimático similar llamado nitrogenasa que cataliza la reducción de N 2 a NH 3(amoniaco), que se puede utilizar como marcador genético para identificar el potencial de fijación de nitrógeno. Una de las características de la nitrogenasa es que el complejo enzimático es muy sensible al oxígeno y se desactiva en su presencia. Esto presenta un dilema interesante para los fijadores de nitrógeno aeróbicos y, en particular, para los fijadores de nitrógeno aeróbicos que también son fotosintéticos, ya que en realidad producen oxígeno. Con el tiempo, los fijadores de nitrógeno han desarrollado diferentes formas de proteger su nitrogenasa del oxígeno. Por ejemplo, algunas cianobacterias tienen estructuras llamadas heterocistos que proporcionan un entorno de bajo oxígeno para la enzima y sirven como el sitio donde ocurre toda la fijación de nitrógeno en estos organismos. Otros fijadores de nitrógeno fotosintéticos fijan nitrógeno solo por la noche cuando sus fotosistemas están inactivos y no producen oxígeno.
Los genes de la nitrogenasa se distribuyen globalmente y se han encontrado en muchos hábitats aeróbicos (por ejemplo, océanos, lagos, suelos) y también en hábitats que pueden ser anaeróbicos o microaerófilos (por ejemplo, intestinos de termitas, sedimentos, lagos hipersalinos, esteras microbianas, crustáceos planctónicos) (Zehr et al . 2003). La amplia distribución de genes fijadores de nitrógeno sugiere que los organismos fijadores de nitrógeno presentan una gama muy amplia de condiciones ambientales, como podría esperarse de un proceso que es fundamental para la supervivencia de toda la vida en la Tierra.
Tabla 1: Procariotas representativos que se sabe que realizan la fijación de nitrógeno
Nitrificación
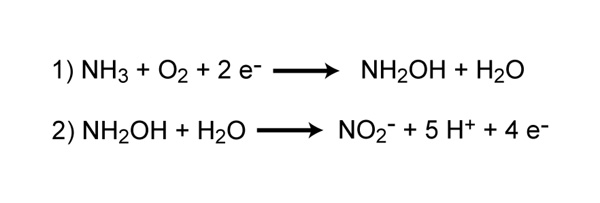
La nitrificación es el proceso que convierte el amoníaco en nitrito y luego en nitrato y es otro paso importante en el ciclo global del nitrógeno. La mayor parte de la nitrificación se produce de forma aeróbica y es realizada exclusivamente por procariotas. Hay dos pasos distintos de nitrificación que se llevan a cabo mediante distintos tipos de microorganismos. El primer paso es la oxidación del amoníaco a nitrito, que es realizada por microbios conocidos como oxidantes de amoníaco. Los oxidantes de amoníaco aeróbicos convierten el amoníaco en nitrito a través del intermedio hidroxilamina, un proceso que requiere dos enzimas diferentes, amoníaco monooxigenasa e hidroxilamina oxidorreductasa (Figura 4). El proceso genera una cantidad muy pequeña de energía en relación con muchos otros tipos de metabolismo; como resultado, los nitrosofiers son notoriamente muy lentos. Adicionalmente,
Figura 4: Reacciones químicas de oxidación del amoniaco realizadas por bacterias.La reacción 1 convierte el amoniaco en el intermedio, hidroxilamina, y es catalizada por la enzima amoniaco monooxigenasa. La reacción 2 convierte la hidroxilamina en nitrito y es catalizada por la enzima hidroxilamina oxidorreductasa.
A diferencia de la fijación de nitrógeno que se lleva a cabo por muchos tipos diferentes de microbios, la oxidación del amoníaco está menos distribuida entre los procariotas. Hasta hace poco, se pensaba que toda la oxidación del amoníaco la realizaban solo unos pocos tipos de bacterias de los géneros Nitrosomonas , Nitrosospira y Nitrosococcus . Sin embargo, en 2005 se descubrió una arqueona que también podía oxidar el amoníaco (Koenneke et al.. 2005). Desde su descubrimiento, a menudo se ha descubierto que las arqueas oxidantes de amoníaco superan en número a las bacterias oxidantes de amoníaco en muchos hábitats. En los últimos años, se ha descubierto que las arqueas que oxidan el amoníaco abundan en océanos, suelos y marismas, lo que sugiere un papel importante en el ciclo del nitrógeno para estos organismos recién descubiertos. Actualmente, solo una arqueona oxidante de amoníaco se ha cultivado en cultivo puro, Nitrosopumilus maritimus , por lo que nuestra comprensión de su diversidad fisiológica es limitada.
El segundo paso en la nitrificación es la oxidación del nitrito (NO 2 – ) a nitrato (NO 3 – ) (Figura 5). Este paso lo lleva a cabo un grupo completamente separado de procariotas, conocido como bacterias oxidantes de nitritos. Algunos de los géneros involucrados en la oxidación de nitritos incluyen Nitrospira , Nitrobacter , Nitrococcus y Nitrospina . De manera similar a los oxidantes de amoníaco, la energía generada por la oxidación de nitrito a nitrato es muy pequeña y, por lo tanto, los rendimientos de crecimiento son muy bajos. De hecho, los oxidantes de amoníaco y nitrito deben oxidar muchas moléculas de amoníaco o nitrito para fijar una sola molécula de CO 2.. Para una nitrificación completa, deben producirse tanto la oxidación del amoniaco como la oxidación del nitrito.
Figura 5: Reacción química de la oxidación del nitrito
Los oxidantes de amoníaco y los oxidantes de nitrito son omnipresentes en los entornos aeróbicos. Se han estudiado exhaustivamente en entornos naturales como suelos, estuarios, lagos y entornos de mar abierto. Sin embargo, los oxidantes de amoníaco y nitrito también juegan un papel muy importante en las instalaciones de tratamiento de aguas residuales al eliminar los niveles potencialmente dañinos de amonio que podrían conducir a la contaminación de las aguas receptoras. Gran parte de la investigación se ha centrado en cómo mantener poblaciones estables de estos importantes microbios en plantas de tratamiento de aguas residuales. Además, los oxidantes de amoníaco y nitrito ayudan a mantener los acuarios saludables al facilitar la eliminación del amonio potencialmente tóxico excretado en la orina de los peces.
Anammox
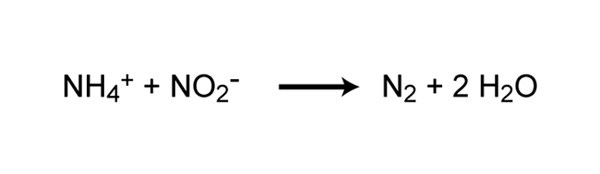
Tradicionalmente, se pensaba que toda la nitrificación se realizaba en condiciones aeróbicas, pero recientemente se descubrió un nuevo tipo de oxidación del amoníaco que se produce en condiciones anóxicas (Strous et al . 1999). Anammox (oxidación anaeróbica de amoniaco) es llevado a cabo por procariotas pertenecientes al filo de Bacteria Planctomycetes. La primera bacteria anammox descrita fue Brocadia anammoxidans.. Las bacterias Anammox oxidan el amoníaco utilizando nitrito como aceptor de electrones para producir nitrógeno gaseoso (Figura 6). Las bacterias Anammox se descubrieron por primera vez en biorreactores anóxicos de plantas de tratamiento de aguas residuales, pero desde entonces se han encontrado en una variedad de sistemas acuáticos, incluidas las zonas del océano con poco oxígeno, sedimentos costeros y estuarinos, manglares y lagos de agua dulce. En algunas áreas del océano, se considera que el proceso de anammox es responsable de una pérdida significativa de nitrógeno (Kuypers et al . 2005). Sin embargo, Ward et al. (2009) argumentan que la desnitrificación en lugar del anammox es responsable de la mayor parte de la pérdida de nitrógeno en otras áreas. Ya sea que el anammox o la desnitrificación sean responsables de la mayor parte de la pérdida de nitrógeno en el océano, está claro que el anammox representa un proceso importante en el ciclo global del nitrógeno.
Figura 6: Reacción química de oxidación anaeróbica de amoníaco (anammox)
Desnitrificación
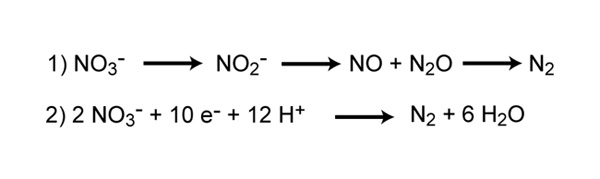
La desnitrificación es el proceso que convierte el nitrato en nitrógeno gaseoso, eliminando así el nitrógeno biodisponible y devolviéndolo a la atmósfera. El gas dinitrógeno (N 2 ) es el producto final final de la desnitrificación, pero existen otras formas gaseosas intermedias de nitrógeno (Figura 7). Algunos de estos gases, como el óxido nitroso (N 2 O), se consideran gases de efecto invernadero, reaccionan con el ozono y contribuyen a la contaminación del aire.
Figura 7: Reacciones involucradas en la desnitrificaciónLa reacción 1 representa los pasos para reducir el nitrato a gas dinitrógeno. La reacción 2 representa la reacción redox completa de desnitrificación.
A diferencia de la nitrificación, la desnitrificación es un proceso anaeróbico, que ocurre principalmente en suelos y sedimentos y zonas anóxicas en lagos y océanos. Similar a la fijación de nitrógeno, la desnitrificación la lleva a cabo un grupo diverso de procariotas, y hay evidencia reciente de que algunos eucariotas también son capaces de desnitrificación (Risgaard-Petersen et al . 2006). Algunas bacterias desnitrificantes incluyen especies de los géneros Bacillus , Paracoccus y Pseudomonas . Los desnitrificantes son quimioorganótrofos y, por lo tanto, también deben suministrarse con alguna forma de carbono orgánico.
La desnitrificación es importante porque elimina el nitrógeno fijo (es decir, el nitrato) del ecosistema y lo devuelve a la atmósfera en una forma biológicamente inerte (N 2 ). Esto es particularmente importante en la agricultura, donde la pérdida de nitratos en los fertilizantes es perjudicial y costosa. Sin embargo, la desnitrificación en el tratamiento de aguas residuales juega un papel muy beneficioso al eliminar los nitratos no deseados del efluente de aguas residuales, reduciendo así las posibilidades de que el agua descargada de las plantas de tratamiento cause consecuencias indeseables (por ejemplo, proliferación de algas).
Amonificación
Cuando un organismo excreta desechos o muere, el nitrógeno en sus tejidos está en forma de nitrógeno orgánico (por ejemplo, aminoácidos, ADN). Luego, varios hongos y procariotas descomponen el tejido y liberan nitrógeno inorgánico de vuelta al ecosistema como amoníaco en el proceso conocido como amonificación. Luego, el amoníaco queda disponible para ser absorbido por las plantas y otros microorganismos para el crecimiento.
Implicaciones ecológicas de las alteraciones humanas en el ciclo del nitrógeno
Muchas actividades humanas tienen un impacto significativo en el ciclo del nitrógeno. La quema de combustibles fósiles, la aplicación de fertilizantes a base de nitrógeno y otras actividades pueden aumentar drásticamente la cantidad de nitrógeno biológicamente disponible en un ecosistema. Y debido a que la disponibilidad de nitrógeno a menudo limita la productividad primaria de muchos ecosistemas, los grandes cambios en la disponibilidad de nitrógeno pueden conducir a alteraciones severas del ciclo del nitrógeno tanto en los ecosistemas acuáticos como terrestres. La fijación de nitrógeno industrial ha aumentado exponencialmente desde la década de 1940 y la actividad humana ha duplicado la cantidad de fijación de nitrógeno global (Vitousek et al . 1997).
En los ecosistemas terrestres, la adición de nitrógeno puede provocar un desequilibrio de nutrientes en los árboles, cambios en la salud de los bosques y una disminución de la biodiversidad. Con una mayor disponibilidad de nitrógeno, a menudo hay un cambio en el almacenamiento de carbono, lo que afecta a más procesos además del ciclo del nitrógeno. En los sistemas agrícolas, los fertilizantes se usan ampliamente para aumentar la producción de las plantas, pero el nitrógeno no usado, generalmente en forma de nitrato, puede filtrarse del suelo, ingresar a arroyos y ríos y finalmente llegar a nuestra agua potable. El proceso de fabricación de fertilizantes sintéticos para su uso en la agricultura haciendo que el N 2 reaccione con el H 2., conocido como el proceso Haber-Bosch, ha aumentado significativamente en las últimas décadas. De hecho, hoy en día, casi el 80% del nitrógeno que se encuentra en los tejidos humanos se originó en el proceso de Haber-Bosch (Howarth 2008).
Gran parte del nitrógeno aplicado a las áreas agrícolas y urbanas finalmente ingresa a los ríos y sistemas costeros cercanos a la costa. En los sistemas marinos cercanos a la costa, los aumentos de nitrógeno a menudo pueden provocar anoxia (falta de oxígeno) o hipoxia (poco oxígeno), alteración de la biodiversidad, cambios en la estructura de la red alimentaria y degradación general del hábitat. Una consecuencia común del aumento de nitrógeno es el aumento de la proliferación de algas nocivas (Howarth 2008). Las floraciones tóxicas de ciertos tipos de dinoflagelados se han asociado con una alta mortalidad de peces y mariscos en algunas áreas. Incluso sin estos efectos económicamente catastróficos, la adición de nitrógeno puede provocar cambios en la diversidad biológica y la composición de especies que pueden provocar cambios en la función general del ecosistema.et al . 2010). Además, los aumentos de nitrógeno en los sistemas acuáticos pueden provocar una mayor acidificación en los ecosistemas de agua dulce.
Resumen
El nitrógeno es posiblemente el nutriente más importante en la regulación de la productividad primaria y la diversidad de especies tanto en los ecosistemas acuáticos como en los terrestres (Vitousek et al . 2002). Los procesos impulsados por microbios, como la fijación de nitrógeno, la nitrificación y la desnitrificación, constituyen la mayor parte de las transformaciones de nitrógeno y desempeñan un papel fundamental en el destino del nitrógeno en los ecosistemas de la Tierra. Sin embargo, a medida que las poblaciones humanas continúan aumentando, las consecuencias de las actividades humanas continúan amenazando nuestros recursos y ya han alterado significativamente el ciclo global del nitrógeno.